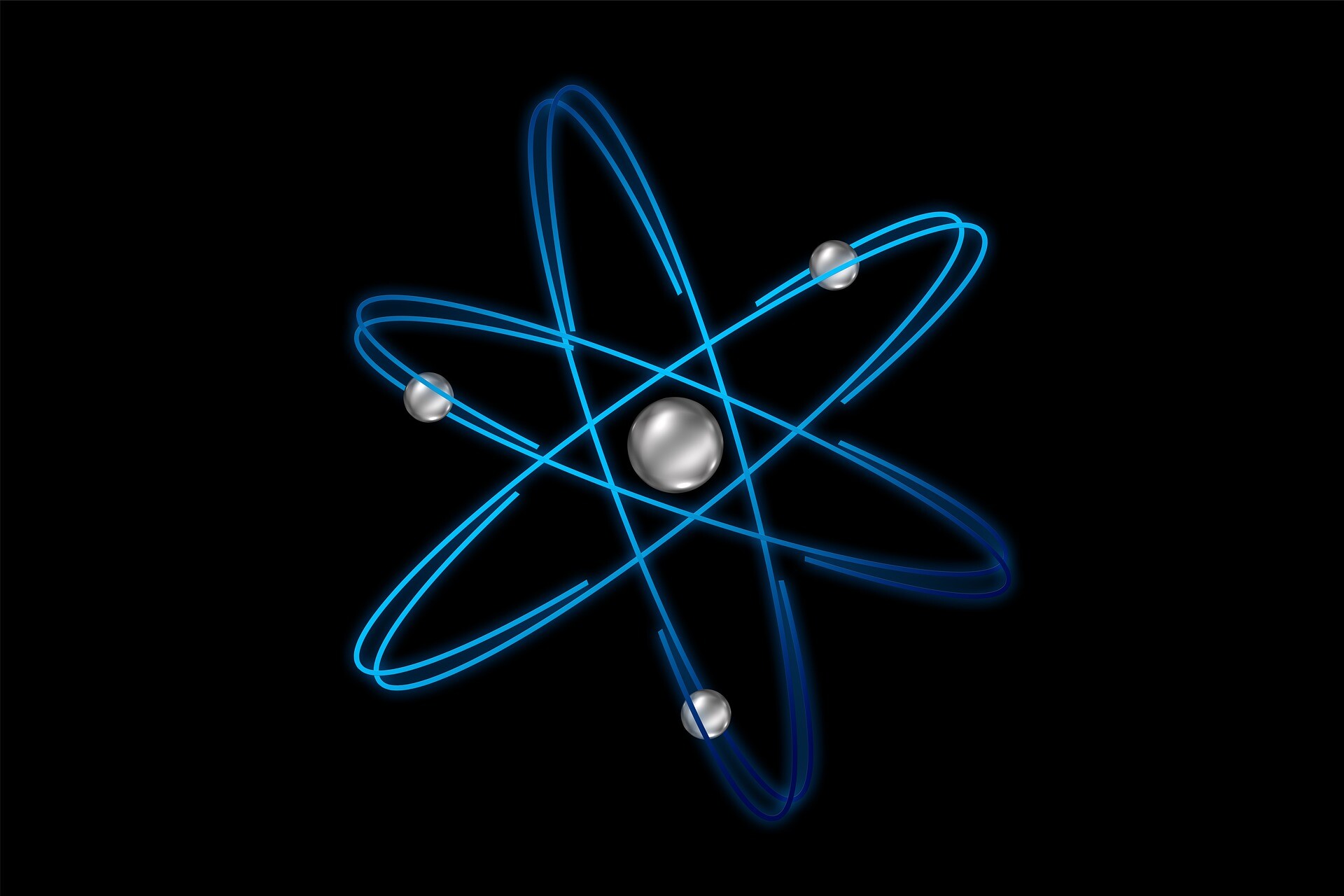
 Antes de preguntarnos qué es un átomo, necesitamos especificar que los átomos existen. Parece una afirmación superflua, pero la humanidad ha pasado más de dos mil años buscando pruebas de su existencia.
Antes de preguntarnos qué es un átomo, necesitamos especificar que los átomos existen. Parece una afirmación superflua, pero la humanidad ha pasado más de dos mil años buscando pruebas de su existencia.
La palabra ‘átomo’, que deriva del griego átomos, ‘indivisible’, fue introducida por el filósofo griego Leucipo para definir las entidades elementales, indestructibles e indivisibles. Los antiguos ya creían que había elementos imposibles de ver que formaban la materia.
Índice
- Qué es un átomo: definición
- Estructura y partes
- Propiedades del átomo
- Cómo se descubrieron los átomos
Qué es un átomo: definición
Toda la materia, viva o no, está formada por una serie de átomos que, combinados entre sí en diferentes proporciones, forman todo lo que conocemos en la Tierra. O en cualquier otra parte del universo conocido. La respuesta a la pregunta de qué es un átomo, por tanto, es: la fracción más pequeña de un elemento capaz de conservar sus características químicas y físicas.
Estructura y partes
El átomo está compuesto por una estructura compleja que consta de diferentes tipos de partículas: protones, neutrones y electrones. Existe un núcleo, que contiene protones y neutrones, y unos electrones que giran a su alrededor, en regiones llamadas orbitales. Los protones y neutrones están formados a su vez por partículas elementales llamadas quarks. Para entender mejor qué es un átomo, veamos cuáles son las tres partículas subatómicas que lo componen.
Protones
El protón es una partícula subatómica compuesta con carga eléctrica positiva, formada por dos quarks up y un quark down unidos por una interacción fuerte y que determinan casi todas las características físicas del átomo. Descubierto por Ernest Rutherford en 1919, el nombre ‘protón’ fue introducido en 1920 por él y deriva del griego antiguo pròton (??????), que significa ‘primero’. Su masa es igual a 1,6726*10?27 kilogramos.
Neutrones
El neutrón también es una partícula subatómica, pero compuesta por un quark up y dos quarks down, con una carga eléctrica neta igual a cero. La carga eléctrica nula es la base de su alta capacidad de penetración y la dificultad de manipulación. Además, no existen fuentes naturales importantes, una razón más para el retraso en su descubrimiento en comparación con las otras dos partículas que componen el átomo. De hecho, el neutrón fue descubierto por una serie de experimentos en la década de 1930. La masa es idéntica a la de los protones.
Electrones
El electrón es una partícula subatómica con carga negativa. Se le considera una partícula elemental. Junto a los protones y neutrones, es un componente del átomo y, aunque aporta menos del 0,06 % de su masa total, caracteriza de forma significativa su naturaleza y determina sus propiedades químicas. La primera evidencia experimental de la existencia de esta partícula se produjo en 1860. El advenimiento de la electrónica y la informática han convertido al electrón en el protagonista del desarrollo tecnológico del siglo XX y XXI.
Propiedades del átomo
El diferente número de protones en el núcleo caracteriza los diversos elementos. Este es el número atómico. El número de nucleones (la suma del número de protones y neutrones) se define, en cambio, como el número de masa (masa atómica o peso atómico).
En un átomo neutro en cuanto a carga eléctrica, el número de protones y neutrones es el mismo y los electrones pueden perderse o ser adquiridos en parte por un átomo en el curso de una reacción química. En este caso, se forman un ion positivo o catión, y un ion negativo o anión. Sin embargo, la individualidad química del átomo permanece inalterada.
La disposición y el número de los electrones más externos determina la reactividad de un átomo. De hecho, el enlace químico que mantiene unidos dos átomos de una molécula no es más que un intercambio de electrones. Por ejemplo, los dos átomos de hidrógeno y el átomo de oxígeno, que forman la molécula de H?O (el agua), están ‘unidos’ por sus electrones.
Por el contrario, los protones solo determinan la masa y el tamaño de un átomo, pero no participan en las reacciones químicas comunes. Su número, a diferencia del de los electrones, permanece constante y cambia solo durante algunas reacciones de desintegración radiactiva, después de las cuales se forman nuevos elementos.
Cómo se descubrieron los átomos
Tras Leucipo y Demócrito, durante más de 2000 años, nadie más se preguntó qué es un átomo. A principios del siglo XIX, un químico inglés, John Dalton, desarrolló una teoría que demostraba que la materia debía estar formada por partículas elementales e indivisibles. Su idea era que estas partículas se combinaban y dividían para formar todas las sustancias del universo. En homenaje a los dos filósofos griegos, Dalton llamó a esta partícula elemental ‘átomo’.
El primer modelo atómico fue introducido por Thomson, denominándolo ‘modelo del pudín de pasas’. El científico descubrió que existían partículas con carga negativa y, por lo tanto, dedujo que también debían existir partículas con carga positiva. Aunque imaginó que estas partículas estaban dispersas al azar alrededor del átomo. Más tarde, el físico neozelandés Ernest Rutherford se dio cuenta del error.
Describió entonces el átomo como un núcleo cargado positivamente con partículas negativas orbitando a su alrededor, como en el sistema solar. Sin embargo, también estaba equivocado. Según ese modelo, de hecho, los electrones deberían perder energía y caer sobre el núcleo. En 1913, el danés Niels Bohr propuso una modificación conceptual al modelo de Rutherford. En su teoría, el electrón estacionaba en órbitas a cierta distancia del núcleo y podía saltar de una órbita a otra si recibía la cantidad correcta de energía.
El físico alemán Arnold Sommerfeld ajustó el modelo de Bohr introduciendo la idea de que las órbitas debían tener diferentes formas elípticas. Su compatriota y colega Max Born, basándose en la ecuación de Schrodinger (mecánica ondulatoria) y ‘fusionándola’ con las conclusiones de Heisenberg (mecánica matricial), elaboró la teoría del orbital: un lugar en el espacio alrededor del núcleo donde se puede encontrar el electrón. Finalmente, en 1932, James Chadwick descubrió el neutrón, por lo que pronto llegó a un modelo completo del átomo.
En Nobbot | La materia no se crea ni se destruye… ¿O sí?
Imágenes | Geralt/Pixbay, Hal Gatewood/Unsplash, Terry Vlisidis/Unsplash

