Parece que todo está inventado, así que sacarse una primicia de la chistera parece una quimera, sobre todo en un sector como el de salud, donde los retos se multiplican.
Medicsen no solo lo ha conseguido, sino que, además, va a cambiar la manera en la que se administran ciertos medicamentos por vía subcutánea.
Esta startup española ha creado el primer wearable que inocula insulina sin necesidad de utilizar agujas gracias a un parche inteligente de pequeñas dimensiones. Han ganado premios como el ‘TOP 35 European Innovators under 35 by MIT Technology review’ y Eduardo Jorgensen, su CEO y médico de formación, entró en la lista ‘Forbes 30 under 30’ en 2018.
– Medicsen nace cuando una niña con diabetes rechazó continuar con su tratamiento de insulina, quejándose de que no podía tener una vida normal. ¿Fue entonces cuando decidió que podía ayudar más a los pacientes desde la tecnología e innovación?
Este encuentro sucedió cuando era estudiante y pasaba consulta con una doctora, que me explicó cómo era la calidad de vida de las personas con diabetes. Al salir de la consulta, hablé con dos compañeros del colegio, César de Mercado y José Carlos Montesinos, que son ingenieros de telecomunicaciones, y Patricia Cremades, compañera de la carrera de medicina, y empezamos a darle vueltas a ver cómo podríamos idear una tecnología que lo solucionara.

– ¿Y qué se les ocurrió?
Fuimos escalando ese primer concepto de páncreas artificial no invasivo a través de una iniciativa que busca un impacto muy transversal en el cuidado de la salud porque las agujas se utilizan para muchas cosas. Al principio no sabíamos por dónde empezar. Unos meses después, en 2014, fui seleccionado para irme a Nueva York (Estados Unidos) gracias al programa StartupsMansion, donde conviví con 40 emprendedores en una misma casa. Al regresar, terminé la carrera de medicina, al igual que mis compañeros. En paralelo, desarrollamos los primeros planes de negocio, nos presentamos a concursos y buscamos ayudas y asesoramiento.
También hablamos con pacientes y viajamos al extranjero para conseguir recursos en países como Finlandia, Dubai e Inglaterra. Luego llegamos a los primeros prototipos de la tecnología con mucha ciencia básica, mucha I+D y avanzando dos pasos para retroceder uno.
– ¿Innovar en un sector como el de la salud genera más obstáculos?
Sí. Existe un proceso regulatorio, estudios clínicos y se requiere de más capital. Es un círculo vicioso: necesitas recursos para validar, pero para validar necesitas recursos. Para romper este círculo hay que ser muy inteligente para saber cuál es el siguiente hito de validación que te va a permitir obtener el siguiente trozo de recursos. Cuando acabas de salir de la universidad, como era nuestro caso, no sabes nada y aprendes a marchas forzadas. Gracias a todo el asesoramiento recibido, hemos sido capaces de desarrollar prototipos que han ido demostrando su valor.
– ¿En qué fase de desarrollo se encuentran?
El año pasado hicimos una prueba muy preliminar con cerdos para probar si el concepto iba bien o no y dio resultados positivos. Este año hemos estado terminando toda la evidencia in vitro y hacia finales de 2022 esperamos tener los primeros resultados en humanos. El objetivo es comercializar el dispositivo en el mercado europeo en 2023 y Estados Unidos en 2025.
– ¿Solo para pacientes diabéticos o con otras patologías?
En el ADN de la compañía está la diabetes porque es el problema más evidente que queremos resolver, pero tiene múltiples aplicaciones. Puede servir para Interferón para esclerosis múltiple o anticuerpos en enfermedades autoinmunes, e incluso para administrar vacunas. Vemos mucho potencial, aunque esto probablemente lo vayamos a establecer a través de acuerdos de licencia tecnológica con la industria farmacéutica.
«El año pasado hicimos una prueba muy preliminar con cerdos y hacia finales de 2022 esperamos tener los primeros resultados en humanos»
– ¿Entonces, ya han mantenido conversaciones farmacéuticas y administraciones públicas?
Las administraciones públicas van a tardar un poco más porque el proceso es más complejo. Una vez tienes los estudios clínicos y lanzas el producto al mercado, hay que empezar a recopilar información farmacoeconómica con la que les puedas convencer. Hasta 2025 vemos muy difícil entrar en políticas de reembolso. En cambio, sí que vemos la posibilidad, en paralelo, de establecer acuerdos con farmacéuticas para que tengan la exclusividad del parche de insulina, con otra para vacunas, y así sucesivamente.
– ¿La intención es que sea un dispositivo económicamente accesible?
Las bombas de insulina más económicas del mercado cuestan aproximadamente 30 £ [unos 35 €] cada tres días. Nosotros no queremos que nuestro dispositivo sea el más caro del mercado. La idea es generar un modelo de suscripción por aproximadamente 100 € al mes, un precio ya validado por el mercado de sensores de monitores continuos de glucosa que cuestan 120 € al mes y tienen millones de suscriptores mundiales.
Esto incluirá todo el servicio técnico para el dispositivo y todos los cartuchos desechables que el paciente necesita al mes. En una primera fase no proveeremos del fármaco porque no somos una farmacéutica, sino una compañía de dispositivos médicos. También queremos pensar en estrategias de reembolso o esponsorización para que aquellos que no se lo puedan permitir puedan acceder gratuitamente.
«En el ADN de la compañía está la diabetes, pero el dispositivo puede utilizarse para inyectar otros fármacos e incluso vacunas»
– Por un lado, existe el wearable y, por el otro, una aplicación móvil. ¿Cuál es su función?
A día de hoy funcionan por separado. La app, que se llama Suggin, recopila información del usuario y le da consejos. Por ejemplo, el usuario puede preguntar qué le pasará si se toma una Coca-Cola en media hora y la app le muestra cuál será su curva de glucosa a futuro. Esto funciona a través de un chatbot. Es gratuita para Android y Huawei y estamos estudiando entrar en Apple en los próximos meses.
El objetivo es que la primera generación del dispositivo que saldrá en 2023 se pueda controlar desde el móvil, que el usuario le diga “ponme tres dosis de insulina”, por ejemplo. Para 2025 queremos integrar ambas piezas para que el parche actúe de forma autónoma conforme lo que le vaya diciendo el software que ha recopilado datos sobre el usuario.
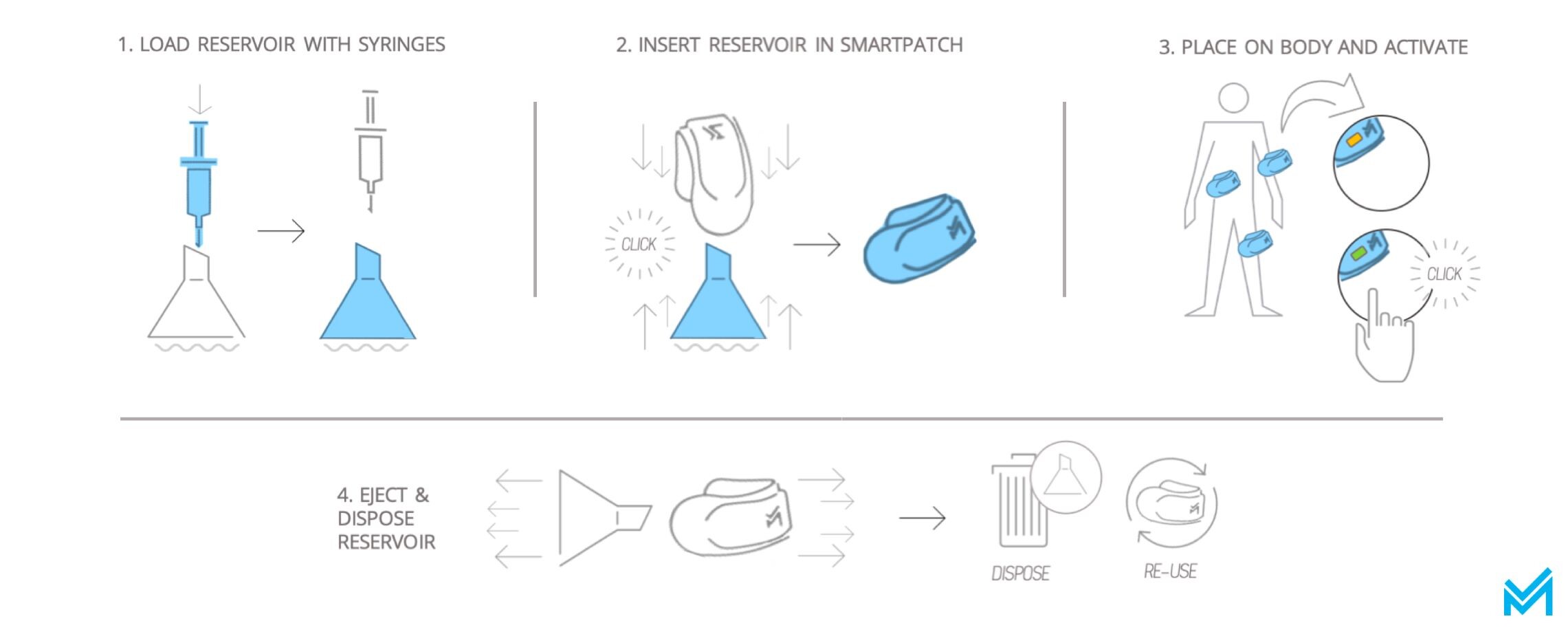
El parche tiene dos partes diferenciadas. Es como una cafetera, por decir algo. Por un lado, tienes el dispositivo y, por el otro, los cartuchos desechables de café. El parche durará un mínimo de tres años y se van poniendo los cartuchos desechables cada vez que se gasten todas las dosis.

– Son pioneros en desarrollar el primer dispositivo de administración de fármacos wearable y sin agujas. Hoy en día que parece que todo está inventado. ¿Cómo han conseguido algo así?
Siendo muy cabezotas. Partimos de un problema y de ahí estudiamos todas las posibilidades que existían para resolverlo; si podíamos modificar el fármaco, aplicando cierta cantidad de energía a la piel… Entonces vimos que el láser era una posibilidad y estuvimos un año desarrollando esta opción, pero al final no funcionó. Esto fue un golpe que nos obligó a situarnos de nuevo en la casilla de partida.
Entonces descubrimos los ultrasonidos, que se habían descrito para la administración de fármacos, pero existían retos por resolver, motivo por el que no se utilizaban para esta aplicación, y mucho menos como wearable. Estos dispositivos tenían que ser enormes y debían enchufarse a la pared. Gran parte de nuestra innovación ha girado en torno a estudiar qué existía en cuanto a la tecnología de ultrasonidos que permitiera incrementar la permeabilidad de la piel.
Primero establecimos cómo podíamos hacerlo de manera estándar, controlada, propia y optimizada para la administración de fármacos. Estuvimos tres años haciendo ciencia básica y pruebas in vitro con piel de cerdo, estimulándola. Una vez definido pasamos a construir la pieza que genera los ultrasonidos que fuera pequeña y alimentada por baterías tradicionales. Ese fue el proceso.
En Nobbot | Videojuegos y robots para enseñar a los niños cómo afrontar la diabetes
Imágenes | Cedidas por Medicsen